Un grupo de la Facultad de Farmacia y Bioquímica con amplio historial en innovaciones biotecnológicas desarrolló, una vez más, un método de purificación, pero en esta ocasión fue para la hormona de crecimiento. El déficit de esta hormona se ha vuelto internacionalmente conocido a partir de que se divulgara que lo había padecido el jugador argentino Lionel Messi, uno de los mejores de la historia del fútbol.
Las proteínas humanas se han utilizado en la medicina desde hace ya algún tiempo, aunque al inicio su abastecimiento fue limitado debido a las pocas fuentes para su extracción. Con la llegada de la biotecnología y la ingeniería genética se han manipulado microorganismos, plantas y animales creando, así, organismos genéticamente modificados (GM) que dieron comienzo a la producción de biofármacos, medicamentos biológicos. Hace unas décadas, con el desarrollo de microorganismos GM se empezaron a elaborar estos fármacos que son principalmente proteínas ‒denominadas recombinantes‒ con utilidad terapéutica como vacunas, enzimas y hormonas.
Desde 1982, ‒con el desarrollo del primer ratón que expresaba la hormona del crecimiento humano‒ se encontró que los animales podrían usarse como biorreactores. Luego, se logró que varios animales GM ‒conejos, cerdos, ovejas, cabras y bovinos‒ también expresaran esta hormona en la leche. La Argentina, desde hace más de una década, forma parte de un selecto grupo de países que desarrollaron bovinos GM o transgénicos que producen la hormona, una innovación que permitiría que una sola vaca abastezca la demanda del mercado latinoamericano, y veinte animales, los requerimientos mundiales.
La somatropina u hormona de crecimiento humano (en inglés Growth Hormone, GH) es una proteína sintetizada por la glándula hipófisis que se encuentra en la base del cerebro. Se produce durante toda la vida, circula en el torrente sanguíneo e interviene en numerosísimas funciones orgánicas. Y, como su nombre lo indica, es necesaria para que los niños aumenten de estatura, pero también ayuda a controlar el metabolismo en todas las etapas de la vida.
El déficit de GH puede afectar el crecimiento durante la infancia y generar múltiples afecciones en la edad adulta. Si bien es difícil establecer la frecuencia del déficit, que puede variar en función de los criterios de diagnóstico y el origen étnico, se calcula que la prevalencia es de 1:4.000 a 1:10.000, en pacientes menores de 15 años. En la Argentina se estima que hay unos 3 mil pacientes en tratamiento con GH, que se popularizó cuando se dio a conocer la historia de Lionel Messi. El astro del fútbol fue diagnosticado con un déficit parcial de GH a los 9 años y recibió tratamiento hasta los 16, habiendo emigrado ya a España, donde pudo costear su tratamiento, y donde más tarde se convertiría en uno de los mejores exponentes del balompié.
En la mayoría de los países la deficiencia de hormona de crecimiento se trata con terapia de remplazo de la GH utilizando la hormona de crecimiento humana recombinante (GH rh), producida en E. coli. La GH rh está indicada para tratar niños con problemas de crecimiento y con bajo peso al nacer, síndrome de Turner, síndrome de Prader-Willi, insuficiencia renal crónica, pérdida de masa muscular y síndrome de intestino corto.
Hormona de crecimiento, un biofármaco en purificación
El elevado precio de los biofármacos restringe enormemente su uso, así y todo, hoy uno de cada cuatro medicamentos en el mercado es un biofármaco. Por ello, la industria está en una constante búsqueda de nuevas tecnologías que disminuyan los costos de producción derivados de la recuperación y la purificación de las proteínas recombinantes, y que representan hasta el 80% del costo.
La naturaleza lábil de los biofármacos hace que tengan que ser inyectados y que, por tanto, requieran de un alto grado de purificación. Los métodos de purificación pueden variar desde simples hasta altamente sofisticados, pero en su mayoría constan de varias etapas que disminuyen su eficiencia.
Recientemente, un grupo de la Cátedra de Biotecnología de la Facultad de Farmacia y Bioquímica de la Universidad de Buenos Aires ha diseñado un proceso de purificación para la hormona de crecimiento desde leche vacuna que, mediante el uso de la cromatografía por afinidad, integra las operaciones y mejora la eficiencia total del proceso. Hasta ahora se ha purificado con éxito la hormona pura colocada en leche descremada comercializada. El siguiente paso es purificar la proteína a partir de leche cruda y finalmente se hará la purificación en leche bovina transgénica.
La cromatografía de afinidad (AC) se basa en el reconocimiento molecular entre la proteína de interés y un ligando inmovilizado. “En nuestro caso, en particular, utilizamos como ligandos péptidos cortos. Lo que hacemos primero es sintetizar bibliotecas combinatorias peptídicas, que son bibliotecas de péptidos cortos, y que tienen todas las combinaciones posibles de los aminoácidos elegidos”, explica la profesora adjunta de la Cátedra de Biotecnología, Silvia Camperi. Y agrega: “Cada péptido se inmoviliza en diminutas bolillas de resina”.
Durante el diseño del péptido hay que lograr la mayor afinidad y selectividad para la proteína de interés, relata Camperi, también investigadora independiente del CONICET. “Cuanto mayor sea la longitud del péptido ‒continúa‒ aumenta la probabilidad de hallar ligandos adecuados, pero también se incrementa la dificultad de la síntesis”. “Más allá de la información disponible para el diseño del péptido, el proceso siempre es ´azaroso' y se tiene que cuidar el costo”, señala por su parte Camila Martínez Ceron, docente de la cátedra e investigadora adjunta del CONICET.
Luego de la síntesis de la biblioteca, los investigadores utilizan un método de screening donde se ponen en contacto las bolillas con los péptidos adheridos y la proteína de interés previamente marcada, por ejemplo, con un colorante fluorescente. La proteína se unirá a las bolillas que contengan péptidos con afinidad a ella. En consecuencia, las bolillas se “verán” fluorescentes, lo que permitirá aislarlas y, así, identificar el péptido. “La parte más desafiante es el screening ya que el péptido debe ser selectivo para la proteína, es decir, que se una preferentemente a la proteína de interés y no a otras moléculas contaminantes y que, al mismo tiempo, sea económicamente viable a nivel industrial”, apunta Martínez Ceron.
En principio este método es útil para purificar cualquier proteína, a menos que no se halle un péptido afín “Los procesos de purificación desarrollados con péptidos permiten aumentar la relación costo-beneficio con respecto a las metodologías convencionales; nuestro método es más económico que otros usados en el laboratorio”, señala Camperi. El grupo aún no ha realizado ensayos a escala industrial, sin embargo, “ya estamos pensando en hacerlo”, concluyen los investigadores.
La Cátedra de Biotecnología de la Facultad de Farmacia y Bioquímica ostenta más de 10 patentes
El Laboratorio tiene amplia experiencia en purificación de proteínas de interés industrial. Por ejemplo, sus miembros trabajaron en la purificación de tripsina y lumbroquinasa. La tripsina es una enzima producida en el páncreas y secretada en el intestino donde es esencial para la digestión. La lumbroquinasa es una enzima proveniente de las lombrices comunes de tierra útil para tratar infartos de miocardio y trombosis. (Nota relacionada: http://www.faba.org.ar/fabainforma/463/Actualidad03.htm)
También patentaron el método de purificación de eritropoyetina recombinante humana (EPO rh), proteína que se usa para tratar pacientes con insuficiencia renal, que requieren de diálisis, y en otras anemias. (Nota relacionada: http://www.cofybcf.org.ar/ver-mas-colegio.asp?1103)
Asimismo, se encuentra en trámite de patentamiento actualmente el método de purificación de la hormona folículoestimulante recombinante humana (FSH rh).
Recientemente, han comenzado además con las pruebas para la purificación de un anticuerpo y de la toxina tetánica.
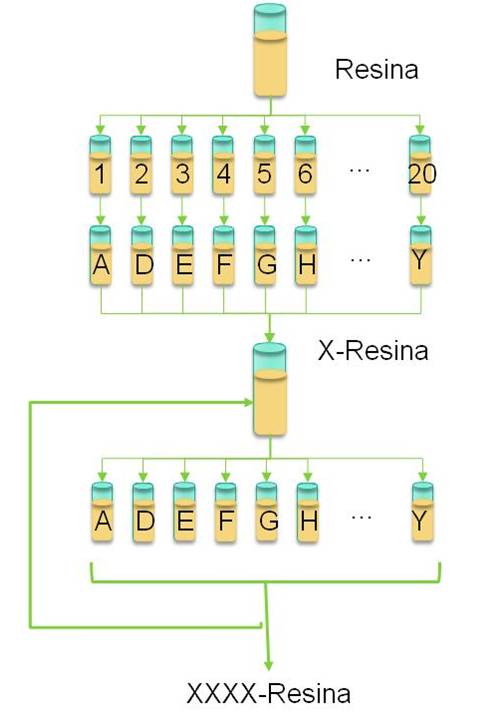
Las bibliotecas combinatorias peptídicas se construyen por el método dividir-acoplar-recombinar (DAR) que consiste en dividir la resina en tantas porciones iguales como número de aminoácidos se quieran variar en la primera posición, acoplar en cada porción un aminoácido diferente, mezclar las porciones y volver a dividirlas para realizar el siguiente acople.

Screening para hallar los péptidos con afinidad por la proteína de interés
Consiste en poner en contacto la biblioteca con la proteína marcada, y luego revelar aquellas bolillas que tengan la proteína inmovilizada, aislarlas e identificar los péptidos de cada bolilla aislada.

Grupo de Química Combinatoria, (de izquierda a derecha) Osvaldo Cascone, Soledad L. Saavedra, Silvia A. Camperi, Camila Martínez Ceron, Silvana Guidicessi y Grabriela R. Barredo.
Glosario
Biorreactor: recipiente o sistema que mantiene un ambiente propicio para el crecimiento de un organismo o la producción de sustancias derivadas de ese organismo.
Ligando: cualquier molécula que se une específicamente a otra.
Péptido: molécula que resulta de la unión de dos o más aminoácidos.
Proteína recombinante: proteínas elaboradas en el laboratorio mediante ingeniería genética en células u organismos distintos a los que las producen naturalmente.
Síndrome de Turner: alteración genética que afecta el desarrollo de las niñas.
Síndrome de Prader-Willi: alteración genética originada por la carencia de un gen.
Bibliografía
Bergadá, I. (2013). Use of growth hormone in children and adolescents | Utilización de la hormona de crecimiento en niños y adolescentes. Medicina (Argentina), 73(3).
Goldberg, L., Rogol, A. D., & Sonksen, P. H. (2009). Hormona del crecimiento: Uso y abuso. The Journal of Clinical Endocrinology & Metabolism, 94(6), E1–E2. Retrieved from http://dx.doi.org/10.1210/jcem.94.6.9991
Lindsay, R., Feldkamp, M., Harris, D., Robertson, J., & Rallison, M. (1994). Utah Growth Study: growth standards and the prevalence of growth hormone deficiency. The Journal of Pediatrics, 125(1), 29–35. http://doi.org/10.1016/S0022-3476(94)70117-2
Moura, R. R., Melo, L. M., & Freitas, V. J. de F. (2011). Production of recombinant proteins in milk of transgenic and non-transgenic goats. Brazilian Archives of Biology and Technology. Scielo.

Ana Valeria Meléndez Mayorga.
Lic. en Química Farmacéutica Biológica por la Universidad Autónoma Metropolitana, México. Máster en Ciencias Biomédicas por la Universidad de Buenos Aires, programa compartido con la Universidad Albert Ludwigs de Friburgo, Alemania. Se especializó en divulgación en el Curso de Divulgación Científica de la Facultad de Farmacia y Bioquímica (UBA).
La nota constituye el trabajo final para la aprobación del Curso de Divulgación Científica de la FFyB-UBA.












Dejar un comentario